2.2 Reaktionsmechanismus der BZR
Belousov bromierte 1950 Citronensäure in Gegenwart von CerIonen. Man hat seitdem verschiedene Möglichkeiten gefunden, sowohl die Citronensäure als auch das Cer zu ersetzen. Darum werde ich im folgenden die BZR mit der einfacheren Malonsäure statt mit Citronensäure darstellen (Strukturformeln siehe Anhang A). Dieser Austausch der Reaktanden hat aber auf den grundlegenden Mechanismus der Reaktion keinen Einfluss. Zunächst die Reaktionsgleichungen des Systems [Field u.a. 1972, Field 1973]: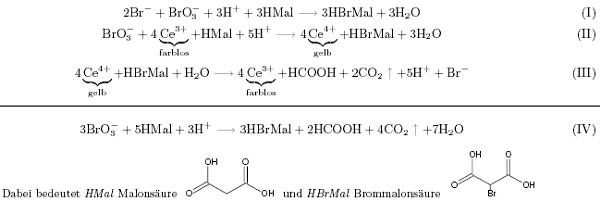
Die Gleichungen (I) und (II) bilden die eigentliche Reaktion, nämlich die Bromierung der Malonsäure. Dieser Schritt alleine würde aber noch kein oszillatorisches Verhalten zeigen. Erst Schritt (III) bildet das entstandene Ce4+ wieder zu Ce3+ und das in (I) verbrauchte wieder zurück. Er erzeugt also die zur Oszillation nötigen Rückkopplungen im System.
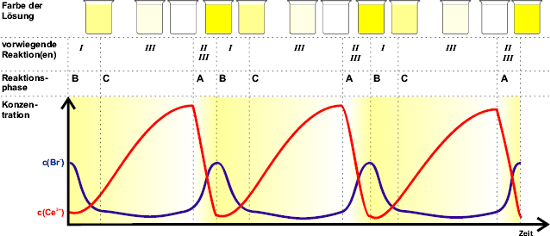
Abb. 1: Reaktionsmechanismus der BZR. Die Großbuchstaben kennzeichnen wichtige Punkte im Reaktionsverlauf, auf die im Text Bezug genommen wird. Die Abbildung zeigt idealisierte Konzentrationskurven und basiert auf meinen Versuchsergebnissen und auf [Field 1973].
Hat man die Edukte (Bromid, Bromat, Malonsäure, Ce3+
und konzentrierte Schwefelsäure) in wässriger Lösung zusammengeführt,
so beginnt die BZR zu oszillieren. Abblidung 1 verdeutlicht das Geschehen.
Nach einer Induktionsperiode erreicht das System Zustand A mit maximaler
Ce3+ und fast minimaler Br--Konzentration. Die Lösung
ist klar. Nun laufen zuerst Reaktion (II) und (III) ab (Phase AB). Reaktion
(I) kann nicht ablaufen, weil kein Bromid vorhanden ist. Mit steigender
Br--Konzentration (durch Ablaufen von Reaktion (III)) wird nun
Reaktion (II) gehemmt und kommt zum Erliegen. Reaktion (III) läuft
langsamer ab, als Reaktion (II)
und verbraucht so weniger Ce4+ als von (II) gebildet wird.
Darum färbt sich die Lösung gelb (Zustand B). Nun kann Reaktion
(I) einsetzen und die Br-Ionen aufbrauchen (Phase BC).
Danach (Zustand C) wird Reaktion (III) überwiegend und beginnt das
Ce3+ wieder aufzubauen (Phase CA). Reaktion (II) kann mangels
Ce3+-Ionen nicht ablaufen. Reaktion (I) läuft jetzt in
sehr geringem Maße ab und hält die Br--Konzentration
in etwa konstant. Wenn alles Ce4+ wieder zu Ce3+
umgewandelt wurde, ist der Ausgangszustand A wieder erreicht und die Lösung
hat sich wieder entfärbt. Neben Brommalonsäure in (I) und (II)
entstehen in
(III) noch Ameisensäure (HCOOH) und Kohlendioxid (CO2).
Das Kohlendioxid entsteht als Gas und perlt aus. Gleichung (IV) ist die
Summengleichung der BZR. Man sieht, dass das System Ce3+ /Ce4+
aus den Gleichungen herausf¨ allt und also als Katalysator interpretiert
werden kann.
Man kann Reaktion (II) auch als RedOxSystem mit zwei Teilgleichungen schreiben:
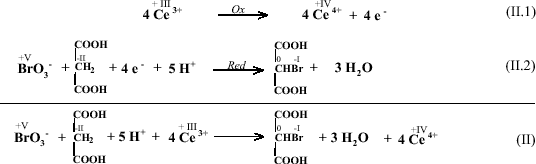
Hier sieht man nun die Aufgaben der einzelnen Substanzen in der BZR. Bromat dient als Oxidationsmittel, das selber reduziert wird (II.2). Die organische Säure (hier wieder Malonsäure) ist das Reduktionsmittel, das oxidiert wird. Die Oxidation findet durch die Substituierung des Broms an das C2Atom statt. Es ändert seine Oxidationszahl von 2 nach. Das Cer dient im gesamten System als Elektronenüberträger. Es wird in (II.1) oxidiert und in (III) wieder reduziert. Zur Ansäuerung des Systems wird konzentrierte Schwefelsäure verwendet.
Es gibt heute mehrere Möglichkeiten das organische Reduktionsmittel zu variieren. Die einzige Bedingung scheint zu sein, dass die entsprechende Substanz eine oder mehrere aktive Methylengruppen (CH2 Gruppen) besitzt, die bromiert werden können, oder solche leicht bei der Oxidation bildet [Zhabotinsky 1964]. Eine Liste solcher Verbindungen findet sich in Tabelle 1.
Aber nicht nur das Reduktionsmittel kann verändert werden. Man kann ebenso das Elektronenüberträgersystem austauschen. Zhabotinsky benutzte statt Ce3+ /Ce4+ auch Mn2+ /Mn3+ . Eine weitere Möglichkeiten ist hier Ferroin/Ferriin (2/3fach geladenes Tri1,10PhenanthrolinEisenIonen).
| org. Reduktionsmittel | Elektronenüberträger |
|---|---|
| Malonsäure | Ce3+ /Ce4+ (farblos/gelb) |
| Citronensäure | Mn2+ /Mn3+ (farblos/rosa) |
| Apfelsäure (= Äpfelsäure) | Ferroin/Ferriin (rot/blau) |
| Gallussäure | Ru(bpy)32+ / Ru(bpy)33+ * |
| Aceton | Ru(phen)32+ / Ru(phen)332+ * |
| Acetessigeste | |
| Acetondicarbonsäure | |
| 2,4Pentandion | |
| 2,5Hexandion |
Tab. 1: Modifizierungen der BZR. Die Raumstrukturen einiger dieser Substanzen finden sich in Anhang A. [Franck 1978, Zhabotinsky 1964]
Der folgende Teil der Arbeit beschreibt die Versuche, die ich durchgeführt
habe. Dabei gibt es zwei Klassen. Zum einen habe ich den Reaktionsablauf
von homogenen gerührten Systemen aufgezeichnet (2.3). Zum anderen
habe ich Fotos der Raumstrukturen aufgenommen, die sich in einer dünnen
Schicht bilden (2.4).

[ Home/Inhalt | Elektronik
| Download | Links
| jkrieger.de | Impressum | Datenschutzerklärung ]
© 2001 by Jan
W. Krieger --- last
updated: 04.08.2019