



2.3.2 Ergebnisse
Standardansatz
Abbildung 3 zeigt eine Reihe von Fotos eines Becherglases mit einem Standardansatz
der BZR (siehe Tabelle
2). Man kann deutlich den Farbwechsel von rot nach blau beim Übergang
von Ferroin nach Ferriin erkennen. Die Fotos entstanden in einem Abstand
von etwa 5 s. Damit ergibt sich die Periodendauer der Reaktion zu ungefähr
30 s.

Abb.3: Fotos des Verlaufs der BZR mit Ferroin
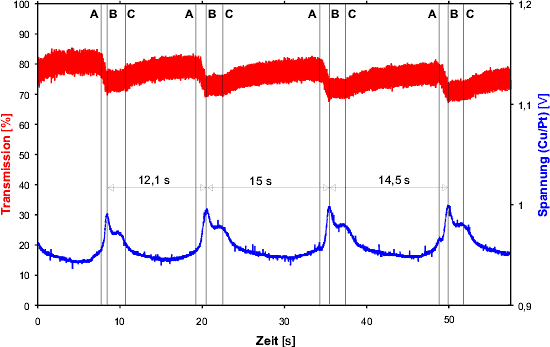
Abb.4:Messkurve des Standardansatzes. Transmissionskurve bei ![]() = 626 nm (rot) und Spannungsdifferenz; Messintervall: 10ms; Temperatur:
23 °C ; Die Großbuchstaben kennzeichnen die gleichen wichtigen
Punkte im Reaktionsverlauf, wie in Abbildung
1. [Datum: 1.12.2000]
= 626 nm (rot) und Spannungsdifferenz; Messintervall: 10ms; Temperatur:
23 °C ; Die Großbuchstaben kennzeichnen die gleichen wichtigen
Punkte im Reaktionsverlauf, wie in Abbildung
1. [Datum: 1.12.2000]
Abbildung 4 zeigt Messkurven von vier Schwingungen
eines Standardansatzes, bei dem die Menge des Ferroins von 1 ml auf 0,5
ml halbiert wurde. Die untere (blaue) Kurve stellt die Schwankungen der
Spannungsdifferenz zwischen der Cu- und der Pt-Elektrode dar. Sie bezieht
sich auf die rechte Achse. Die linke Achse gehört zur oberen (roten)
Kurve und gibt die Transmission bei ![]() = 626 nm an. Die gemittelte Periodendauer beträgt 13,9 s, was einer
Frequenz von 0,072 Hz entspricht. Aus mehreren anderen Messreihen hat sich
ergeben, dass die Abweichungen der Periodendauer vom jeweils errechneten
Mittelwert bis zu 8 % beträgt. Die durchschnittliche Abweichung liegt
zwischen 2 % und 3 % . ZHABOTINSKY gibt für die
Frequenzstabilität über einige Perioden ,,1 % und höher``
[Zhabotinsky 1964] an.
= 626 nm an. Die gemittelte Periodendauer beträgt 13,9 s, was einer
Frequenz von 0,072 Hz entspricht. Aus mehreren anderen Messreihen hat sich
ergeben, dass die Abweichungen der Periodendauer vom jeweils errechneten
Mittelwert bis zu 8 % beträgt. Die durchschnittliche Abweichung liegt
zwischen 2 % und 3 % . ZHABOTINSKY gibt für die
Frequenzstabilität über einige Perioden ,,1 % und höher``
[Zhabotinsky 1964] an.
Vergleicht man die Kurve der Spannungsdifferenz mit Kurven die für die Bromidkonzentration in der Literatur [Field u.a. 1972, Field, Schneider 1988, Kondepudi, Prigogine 1998] angegeben werden (siehe auch Abbildung 1), so erkennt man, dass sich diese weitgehend entsprechen. Die gemessene Spannungsdifferenz ist also ein Maß für die Bromidkonzentration. Es haben zwar auch die anderen Ionen einen Einfluss auf diesen Wert, er scheint aber für seine Änderung fast nicht von Bedeutung zu sein.
Schnelle Schwankungen der Lichtkurve (rot) um den Mittelwert machen diese zu einem breiten Band. Die Breite des Bandes beträgt je etwa 5 % des Mittelwertes nach oben bzw. nach unten. Diese Abweichungen entstehen durch die CO2-Gasbläschen, die während der Reaktion im Gefäß aufsteigen und den Strudel, den das ,,Fischlein`` des Magnetrührers verursacht. Beide streuen das eingestrahlte Licht und ändern folglich die Intensität des ausgestrahlten Lichtes. Auf den bereits am Anfang beschriebenen Fotos der BZR (Abb. 3) kann man die eben erwähnten Gasbläschen gut sehen. Den Strudel kann man besonders in der blauen Phase als dunklen, keilförmigen Schatten am oberen Flüssigkeitsrand erkennen.
Die Transmissionskurve muss der Konzentration der roten Ferroin-Ionen
proportional sein, da diese die Transmission im roten Spektralbereich der
LED ,,steuern``.
Standardansatz mit Temperaturerhöhung
Es ist bekannt, dass sich die Reaktionsgeschwindigkeit vieler Reaktionen
durch die Änderung der Umgebungstemperatur beeinflussen lässt.
Dasselbe gilt auch für die BZR. Darum habe ich ein Experiment durchgeführt,
in dem ich die Temperatur eines Standardansatzes kontinuierlich von etwa
23 °C (Zimmertemperatur) auf 44 °C erhöht habe. Die Aufheizung
erfolgte durch die im Magnetrührer eingebaute Heizung. Zur Messung
habe ich ein einfaches Quecksilber-Thermometer verwendet. Das Vorgehen
beim Versuch blieb sonst unverändert. Abbildung
5 zeigt die Ergebnisse.
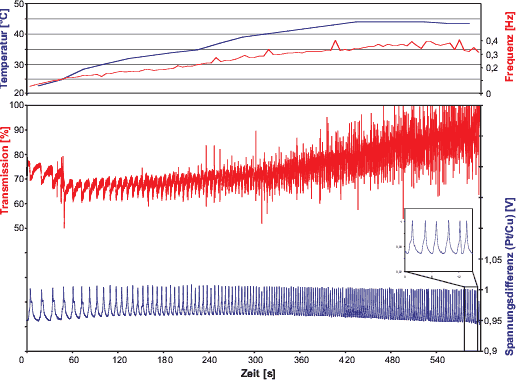
Abb. 5: Messung an der BZR mit Temperaturerhöhung. Oben:
Temperatur (blaue Kurve) und Frequenz (rote Kurve). Unten: Transmission
(rote Kurve) und Spannungsdifferenz (blaue Kurve); Messintervall: 10ms;
Anfangstemperatur: 23°C ; Endtemperatur: 44°C ; für die Darstellung
wurde jeweils über 6 Messwerte gemittelt
[Datum: 1.12.2000]
Im oberen Diagramm zeigt die blaue Kurve den Anstieg der Temperatur
und die rote die Frequenz der Schwingungen zum jeweiligen Zeitpunkt. Die
Temperaturen wurden per Hand mitprotokolliert und in Abbildung
5 als Graph dargestellt. Die Werte für die Frequenzkurve wurden
aus der Spannungskurve durch Ausmessen und Umrechnen bestimmt. Das untere
Diagramm zeigt die Transmission bei ![]() nm und die Spannungsdifferenz zwischen Pt und Cu. Wie man sieht, nimmt
die Frequenz der Schwingungen rapide zu, wenn man die Temperatur erhöht.
Trägt man die Frequenz (als Maß für die RG) gegen die Temperatur
auf, so erkennt man einen exponentiellen Zusammenhang, wie ihn die Arrhenius-Gleichung
(
nm und die Spannungsdifferenz zwischen Pt und Cu. Wie man sieht, nimmt
die Frequenz der Schwingungen rapide zu, wenn man die Temperatur erhöht.
Trägt man die Frequenz (als Maß für die RG) gegen die Temperatur
auf, so erkennt man einen exponentiellen Zusammenhang, wie ihn die Arrhenius-Gleichung
(![]() nach [Mortimer 1987]) beschreibt.
Abbildung
6 zeigt diesen Graphen. In der Fortführung des beschriebenen Experiments
konnte gezeigt werden, dass sich die ursprüngliche Periodendauer erneut
einstellt, wenn man die Lösung wieder abkühlt. Die ,,Ausfransungen``
der Transmissionskurve werden umso stärker, je höher die Temperatur
wird. Bei hohen Temperaturen kann man die eigentlichen Schwingungen gar
nicht mehr ausmachen. Dies liegt daran, dass durch die Erhöhung der
RG auch mehr CO2 ensteht, das den Lichtstrahl, wie vorher beschrieben,
beeinflusst.
nach [Mortimer 1987]) beschreibt.
Abbildung
6 zeigt diesen Graphen. In der Fortführung des beschriebenen Experiments
konnte gezeigt werden, dass sich die ursprüngliche Periodendauer erneut
einstellt, wenn man die Lösung wieder abkühlt. Die ,,Ausfransungen``
der Transmissionskurve werden umso stärker, je höher die Temperatur
wird. Bei hohen Temperaturen kann man die eigentlichen Schwingungen gar
nicht mehr ausmachen. Dies liegt daran, dass durch die Erhöhung der
RG auch mehr CO2 ensteht, das den Lichtstrahl, wie vorher beschrieben,
beeinflusst.
Die Frequenzstabilität nimmt mit dem Anstieg der Temperatur ab. Dies sieht man am nicht mehr so glatten Verlauf der Frequenzkurve.
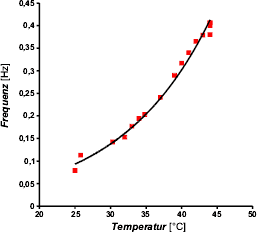
Abb. 6: Oszillationsfrequenz als Funktion der Temperatur der
Lösung. Rote Punkte: gemessene Werte. Schwarze Kurve: angepasste Exponentialfunktion.
Standardansatz mit Erhöhung
des pH-Wertes
Eine weitere Möglichkeit, die Oszillationsfrequenz der BZR zu variieren,
ist die Erhöhung des pH-Wertes. Für diesen Versuch habe ich wieder
einen Standardansatz verwendet, diesmal allerdings mit 1 ml Ferroin. Die
Säure habe ich in 1 ml-Schüben (3 M H2SO4)
aus einer Handpipette zugegeben.
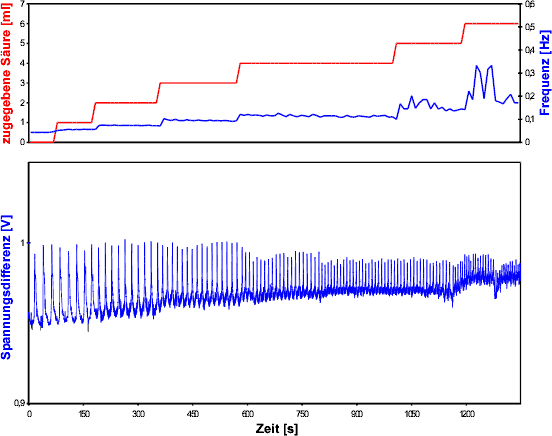
Abb. 7: Mesuung an der BZR mit schrittweiser Erhöhung des
pH-Wertes. Oben: zugegebene Säuremenge mit c(H2SO4)
= 3M (rote Kurve) und Frequenz (blaue Kurve). Unten: Spannungsdifferenz
(blaue Kurve); Messintervall: 50ms; Anfangstemperatur: 24°C ; [Datum:
1.12.2000]
Abbildung 7 zeigt die Ergebnisse des Versuches.
Die rote Kurve im oberen Diagramm stellt die Zugabe der Säure dar.
Die blaue Kurve ist wieder die Frequenzkurve. Das untere Diagramm zeigt
nur die Spannungsdifferenz, da die Transmissionskurve durch die Zugabe
von Flüssigkeit sehr gestört und somit fast unbrauchbar ist.
Zuerst fällt auf, dass sich die Spannungsdifferenz verkleinert. Sie
ist am Schluss nicht einmal mehr halb so groß, wie am Anfang. Dies
rührt wohl daher, dass sich die zugegebenen H3O+-Ionen
ebenfalls auf die Spannungsdifferenz auswirken, und somit der Effekt, den
die restlichen Ionen auf diesen Wert haben, geringer wird. Dies wird dadurch
untermauert, dass die Amplitude in Sprüngen abnimmt, die der Zugabe
der Säure entsprechen. Des weiteren kann man sehen, dass sich die
Frequenz der Oszillationen ebenfalls in Sprüngen mit der pH-Wert-Zunahme
erhöht. Dabei fällt auch auf, dass hohe Säure-Konzentrationen
die Stabilität der Oszillationen beeinflussen. Dies sieht man daran,
dass die Frequenz umso stärker schwankt, je mehr Säure zugegeben
wurde.Die Periodendauer betrug am Anfang - also ohne zugegebene Säure
- ca. 23,3 s (![]() 0,043 Hz). Sie fiel bis auf etwa 5,5 s (
0,043 Hz). Sie fiel bis auf etwa 5,5 s (![]() 0,182 Hz). Dies stellt fast eine Verfünffachung der Frequenz dar.
0,182 Hz). Dies stellt fast eine Verfünffachung der Frequenz dar.
Standardansatz mit veränderter
Ferroin-Konzentration
Dieser Absatz soll nur eine kurze Ergänzung zu den vorangegangenen
Beschreibungen sein. Man kann nämlich aus den vorherigen Ausführungen
noch eine weitere Möglichkeit zur Änderung der Oszillationsfrequenz
herauslesen. Diese ist die Änderung der Ferroin-Konzentration, denn
es dauert ja schließlich länger, mehr Ferroin zu oxidieren/reduzieren.
Im letzten Versuch (pH-Erhöhung) wurde doppelt soviel Ferroin (1
ml) verwandt, wie in den vorrausgegangenen (0,5 ml). Stellt man nun die
Anfangsperiodendauern gegenüber, so stellt man fest, dass diese bei
doppelter Ferroin-Konzentration auch fast doppelt so hoch sind. In den
ersten beiden Versuchen hatte die erste Schwingung eine Länge von
13,9 s bzw. 12,6 s. Im letzten Versuch hingegen dauerte die erste Schwingung
23,3 s.
Standardansatz mit Mn2+/
Mn3+ als Katalysator
Die nun folgenden letzten beiden Versuche befassen sich mit der Variation
des Elektronenüberträgersystems. Zuerst habe ich statt der Ferroin-Lösung
eine etwa gleichkonzentrierte (0,001 M) Mn2+-Lösung verwendet.
Diese erhält man aus 2 mg MnSO4 * H2O auf 10
ml Wasser. Von dieser Lösung habe ich etwa 1 ml eingesetzt.
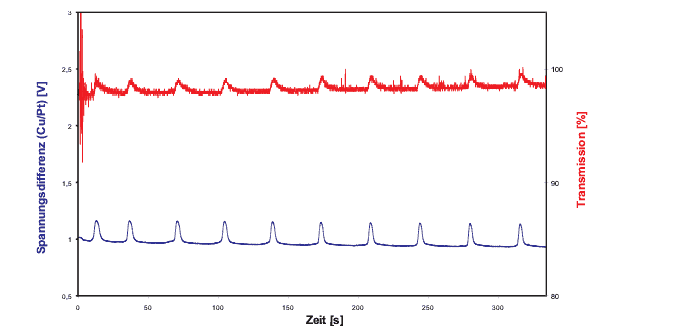
Abb. 8: Standardansatz der BZR mit 1 ml 0,001 M- Mn2+-Lösung
als Elektronenüberträgersystem. Rote Kurve: Transmission. Blaue
Kurve: Spannungsdifferenz (Cu/Pt). Messintervall: 50 ms [Datum:
1.12.2000]
Abbildung 8 zeigt die Ergebnise des Versuches.
Die Transmission (blaue Kurve) ändert sich kaum sichtbar um 2-3%.
Dafür ist die Amplitude der Spannungskurve (rot) mit 0,2 V etwa vier
mal so hoch, wie bei Ferroin (![]() 0,05 V). Die Störungen am Anfang der Lichtkurve gehen darauf zurück,
dass erst dort die Mn2+-Lösung zugegeben wurde. Darum wird
bei der Berechnung der Periodendauern die erste Periode als Einschwingperiode
nicht mitgewertet. Die durchschnittliche Periodendauer beträgt 34,8
s (
0,05 V). Die Störungen am Anfang der Lichtkurve gehen darauf zurück,
dass erst dort die Mn2+-Lösung zugegeben wurde. Darum wird
bei der Berechnung der Periodendauern die erste Periode als Einschwingperiode
nicht mitgewertet. Die durchschnittliche Periodendauer beträgt 34,8
s (![]() 0,029 Hz) bei einer durchschnittlichen Abweichung von
0,029 Hz) bei einer durchschnittlichen Abweichung von ![]() 0,7 s (
0,7 s (![]() 2,0 %). Damit ist die Periodendauer etwa 1,5-mal so groß, wie bei
einem Ansatz mit Ferroin der gleichen Konzetration.
2,0 %). Damit ist die Periodendauer etwa 1,5-mal so groß, wie bei
einem Ansatz mit Ferroin der gleichen Konzetration.
Da die Transmissionskurve hier horizontal spiegelverkehrt zur Transmissionskurve
bei Ferroin verläuft, ist wohl die oxidierte DForm des Elektronenüberträgersystem
(also Mn3+) farbbestimmend.
Standardansatz mit Ce3+/
Ce4+ als Katalysator
Dieser Versucht gleicht demjenigen mit Mn2+-Lösung. Nur
wird hier statt dem System Mn2+/ Mn3+ das System
Ce3+/ Ce4+ verwendet. Außerdem wurden 2 ml
Ce3+-Lösung zugegeben, da bei Zugabe von 1 ml die Oszillation
nach 2 Perioden aufhörte. Die 0,001 M Ce3+-Lösung
erhält man, wenn man 0,055g Ammonium-Cer(IV)-Nitrat ( (NH4)2Ce(NO3)6)
in 10 ml Wasser löst.
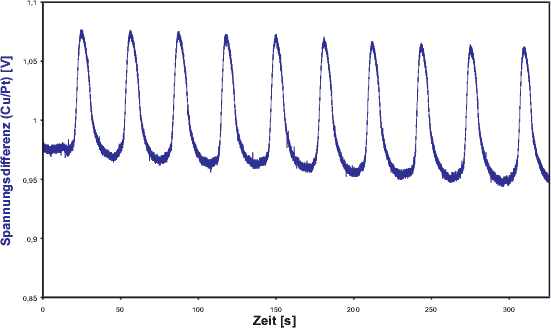
Abb. 9: Standardansatz der BZR mit 2 ml 0,001 M Ce3+-Lösung
als Elektronenüberträgersystem. Blaue Kurve: Spannungsdifferenz
(Cu/Pt). Messintervall: 50ms [Datum: 1.12.2000]
Abbildung 9 zeigt nur die Spannungskurve.
Das Cer verursachte in der eingesetzten geringen Konzentration keine messbare
Transmissionsschwankung. Die durchschnittliche Periodendauer liegt bei
31,7 s (![]() 0,032 Hz) mit einer durchschnittlichen Abweichung von
0,032 Hz) mit einer durchschnittlichen Abweichung von ![]() 0,9 s (
0,9 s (![]() 2,8 %). Durch die Zugabe von 2 ml Ce3+-Lösung können
diese Werte wegen mangelnder Standardisierung nicht mit denen des Ferroins
oder des Mangans verglichen werden.
2,8 %). Durch die Zugabe von 2 ml Ce3+-Lösung können
diese Werte wegen mangelnder Standardisierung nicht mit denen des Ferroins
oder des Mangans verglichen werden.
Der ursprüngliche Ansatz
von BELOUSOV
Abbildung 10 zeigt ein Becherglas mit dem Ansatz
für die BZR den BELOUSOV in seinem ersten Artikel
angibt. Leider ist der Farbunterschied nur schwer auszumachen. Deshalb
wurden die Bilder digital etwas nachbearbeitet. Das Zeitintervall zwischen
zwei Bildern beträgt etwa 5 s.

Abb. 10: Ursprünglicher Ansatz von B. P. BELOUSOV . Der
Abstand zwischen den Aufnahmen beträgt 5 s.
BELOUSOV gibt folgendes Rezept an: ,,Nach unserer
Erfahrung eignet sich für die Beobachtung der Verfärbung bei
Zimmertemperatur besonders gut eine wäßrige Lösung, von
der 10,0 ml neben Wasser 2,00 g Zitronensäure, 0,16 g Cersulfat, 0,20
g Kaliumbromat und 2,0 ml verdünnte Schwefelsäure (1:3) enthalten``
[Belousov 1959, Übersetzt
von E. Gey, Berlin]. Die Oszillationsperiode beträgt hier etwa 25
s.

[ Home/Inhalt | Elektronik
| Download | Links
| jkrieger.de | Impressum | Datenschutzerklärung ]
© 2001 by Jan
W. Krieger --- last
updated: 04.08.2019
